遺伝子の転写を調節しているのは、タンパク質である。転写調節因子とよばれるタンパク質が特定の塩基配列をもつDNAに結合し、転写を活性化または抑制する。では、転写調節因子は、どのように塩基配列を認識して結合するのでしょうか。
塩基配列は、DNAを開かずに読み取れる
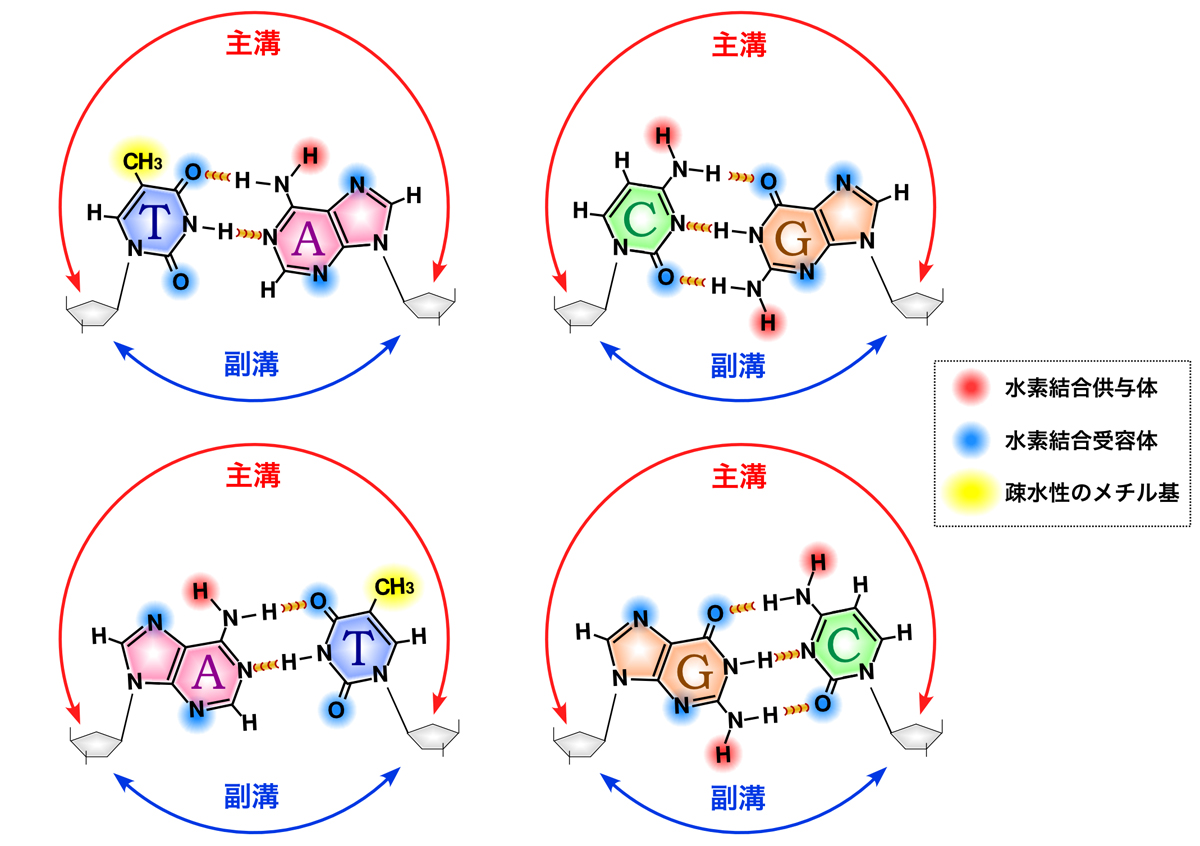
RNAポリメラーゼがDNAの塩基配列と相補的なRNAを合成するためには、DNAの二重らせんを開いて解かなくてはならない。では、転写調節因子もDNAを開いてその塩基配列を読み取っているのだろうか。実は、DNAを開かなくても塩基配列を示す特徴を主溝側から読み取ることができる。
DNAのらせん軸と垂直に塩基対の平面が積み重なっているため、主溝と副溝からは塩基対の縁にアクセスできる。塩基対の縁には水素結合の供与体/受容体・疎水性のメチル基が露出しており、それらの配置パターンによって塩基配列を認識できるのである。
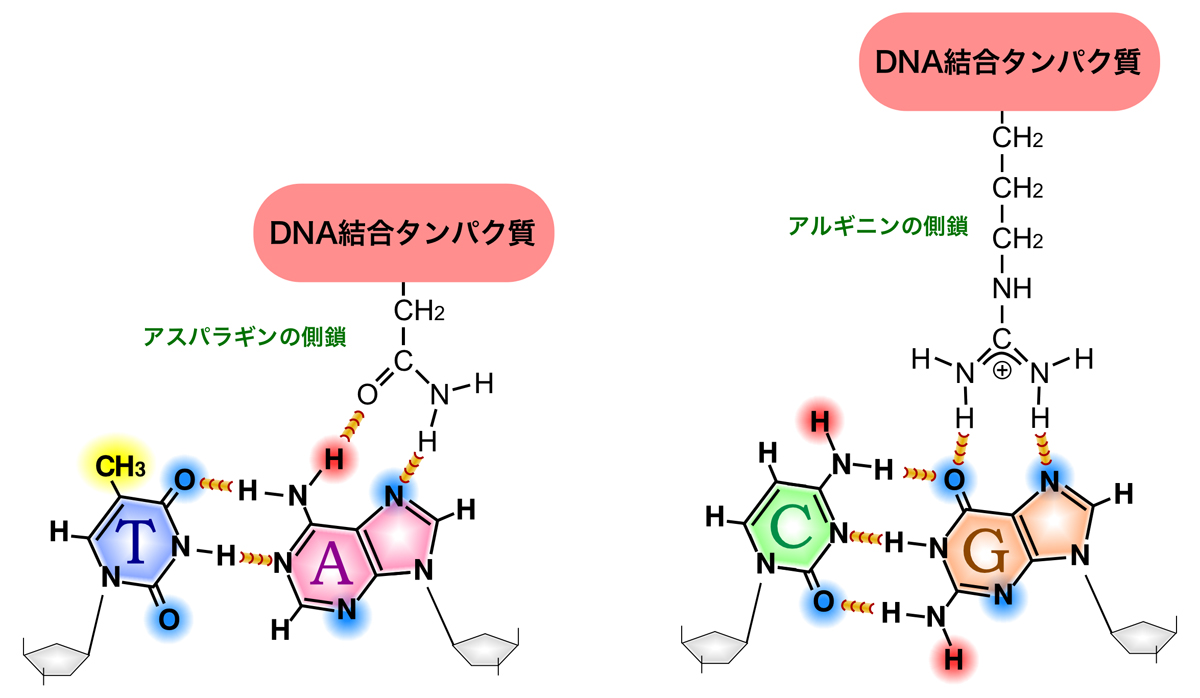
一方、タンパク質を構成するアミノ酸にも、極性アミノ酸と非極性アミノ酸があり、極性アミノ酸の側鎖にはDNA塩基対と相互作用可能な水素結合供与体/受容体が存在する。そこで、DNAの水素結合供与体/受容体・疎水性部分の配置パターンと、タンパク質の水素結合受容体/供与体・疎水性部分の配置パターンが適合すれば、そのタンパク質は水素結合や疎水性相互作用を介してDNAの特定の塩基配列を認識できるのである。
しかし、ただ水素結合受容体/供与体の配置パターンが適合すればDNAに結合できるわけではなく、タンパク質自体がαヘリックスなどの二次構造を介して特定の立体構造をとる必要がある。そこで、以下にDNAに結合するための立体構造(DNA結合モチーフ)を紹介しよう。
ヘリックス-ターン-ヘリックス
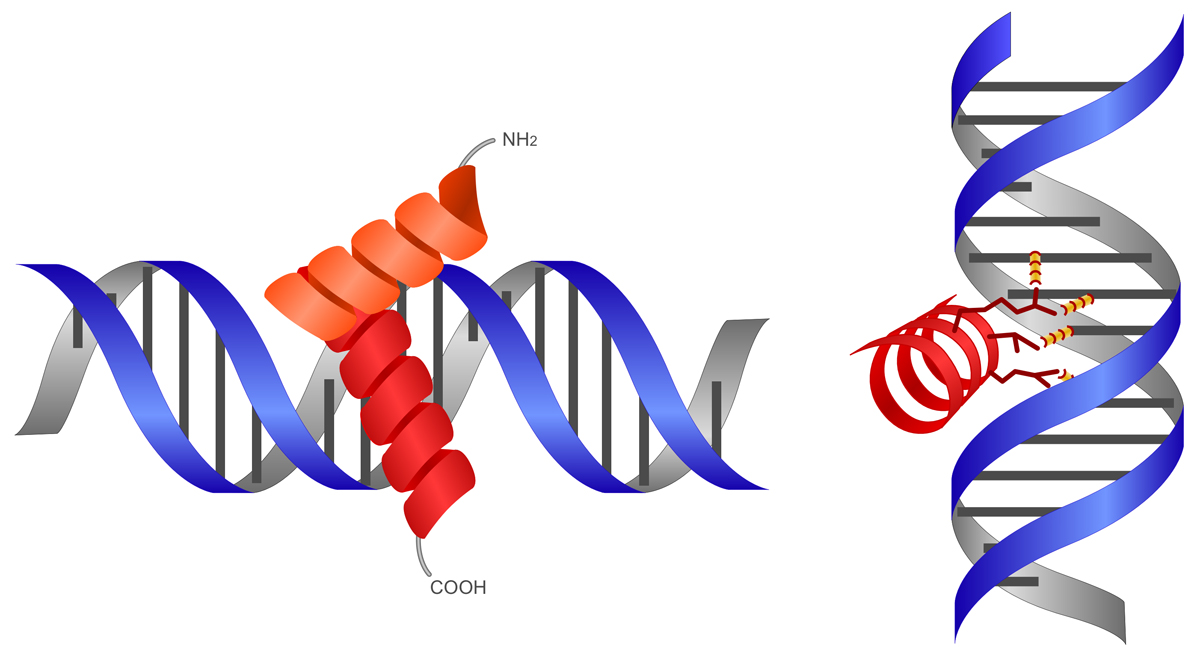
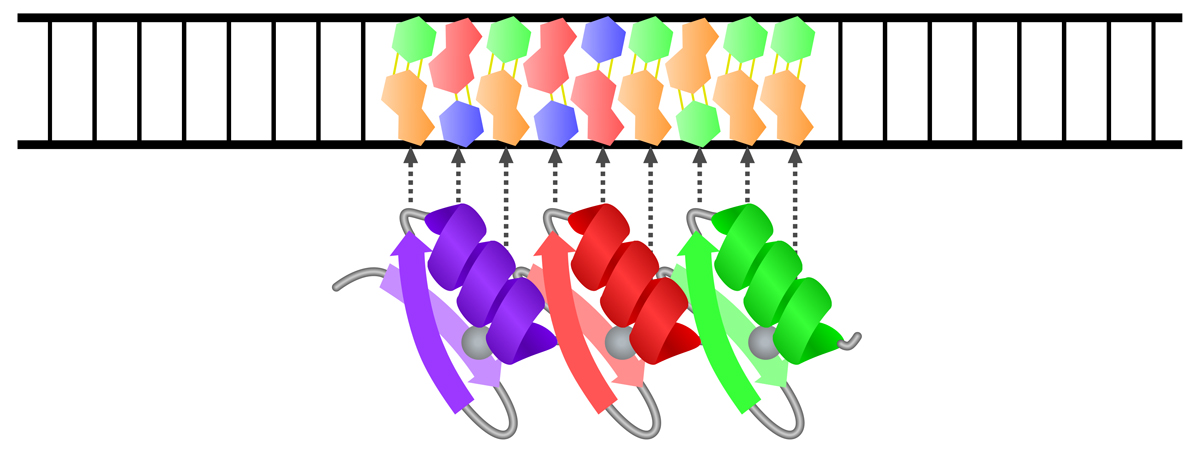
ヘリックス-ターン-ヘリックス(helix-turn-helix, HTH)は、2個のαヘリックスが折り返し(ターン)で連結された構造であり、約20アミノ酸のポリペプチドで形成される。C末端側の第2ヘリックスが認識ヘリックスとしてはたらき、DNAの主溝にはまることで特定の塩基配列に結合する。
第1ヘリックスは、主溝に覆いかぶさるようにして主鎖(糖-リン酸骨格)と接触する。第2ヘリックス(認識ヘッリックス)は主溝にはまり、ヘリックスの外側に突き出たアミノ酸側鎖がDNAの塩基対と水素結合を形成することにより、特定の塩基配列に結合する。
ヘリックス-ターン-ヘリックスは、真核生物や原核生物の多くのDNA結合タンパク質に利用されている。
ジンクフィンガー
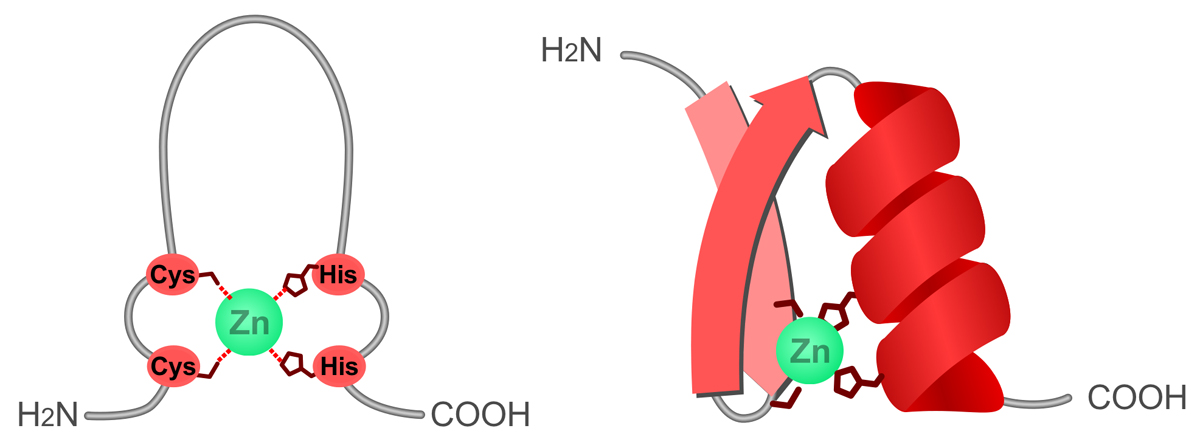
ジンクフィンガー(zinc finger, Zn-finger)は、原核生物のタンパク質には稀だが、真核生物には非常によく見られるモチーフである。いろいろなタイプのジンクフィンガーがあるが、共通しているのは構成成分に1個以上の亜鉛原子が含まれることである。
ここでは一例として、Cys2His2フィンガーを説明しよう。Cys2His2フィンガーは、2個のシステインと2個のヒスチジンを含む約30個程度のアミノ酸により形成され、亜鉛を仲介とした一対のαヘリックスとβシートで構成される。αヘリックスがDNAの主溝に接して塩基配列を認識している。
DNAに結合するタンパク質には、ジンクフィンガーが繰り返されているものがある。1個のジンクフィンガーが認識するのは3塩基のため、ジンクフィンガーを繰り返して複数個もつことにより、結合の強さや特異性を上昇させることができる。
ヘリックス-ターン-ヘリックスもジンクフィンガーも、αヘッリックスがDNAの主溝にはまって塩基配列を識別する。しかし、ここでは詳述しないが、MetリプレッサーやTATA結合タンパク質(TBP)のようにβシートを介して結合するものや、TALEのようにこれらの二次構造ではなくループを介して結合するものもある。
より合わせコイル
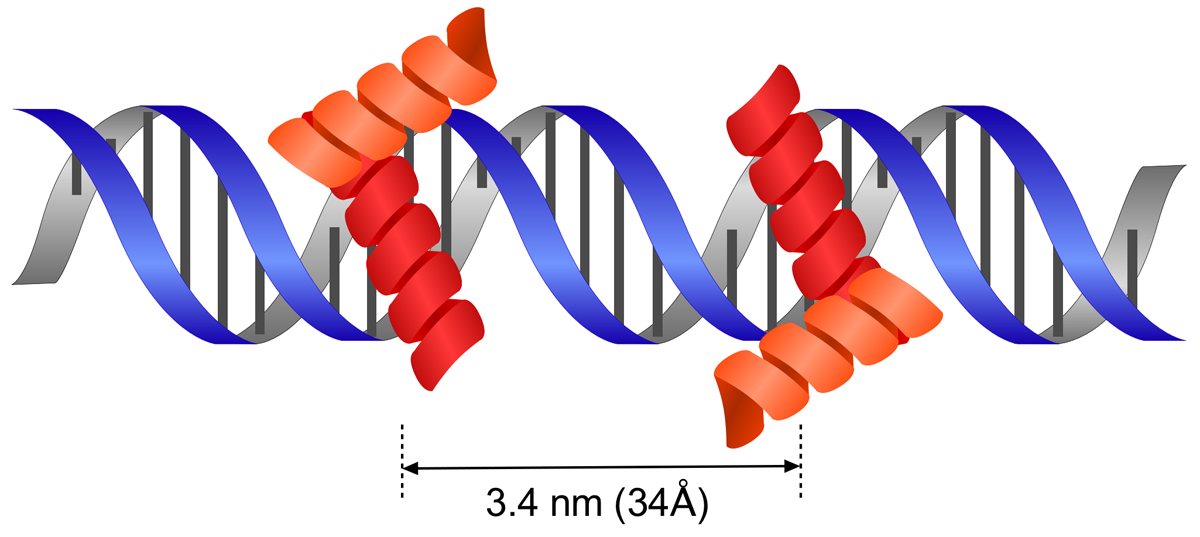
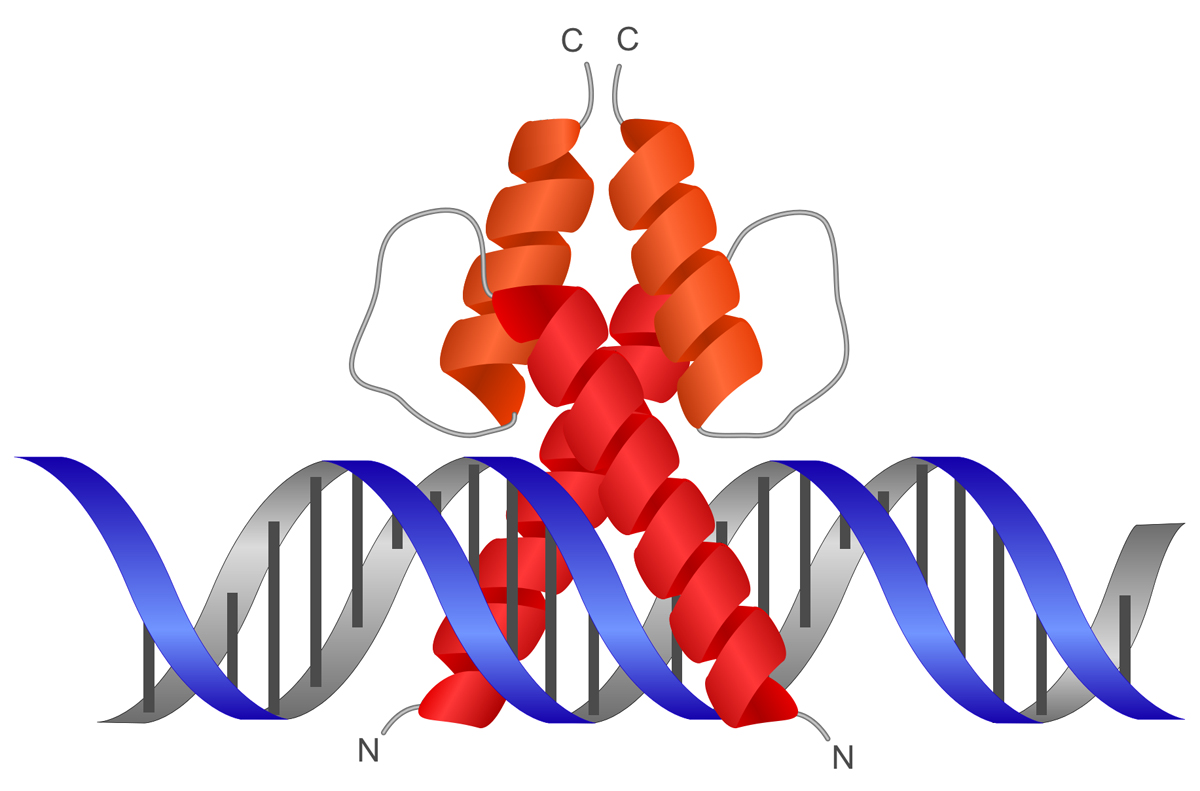
原核生物の転写調節因子は、よく二量体を形成する。そうすることで、結合の親和性や特異性を高める。その場合、識別ヘリックスが3.4 nm(34Å)離れるように会合すれば、ちょうど隣接する2つの主溝に結合できるようになる。そこで以下では、二量体化するしくみを見てみよう。
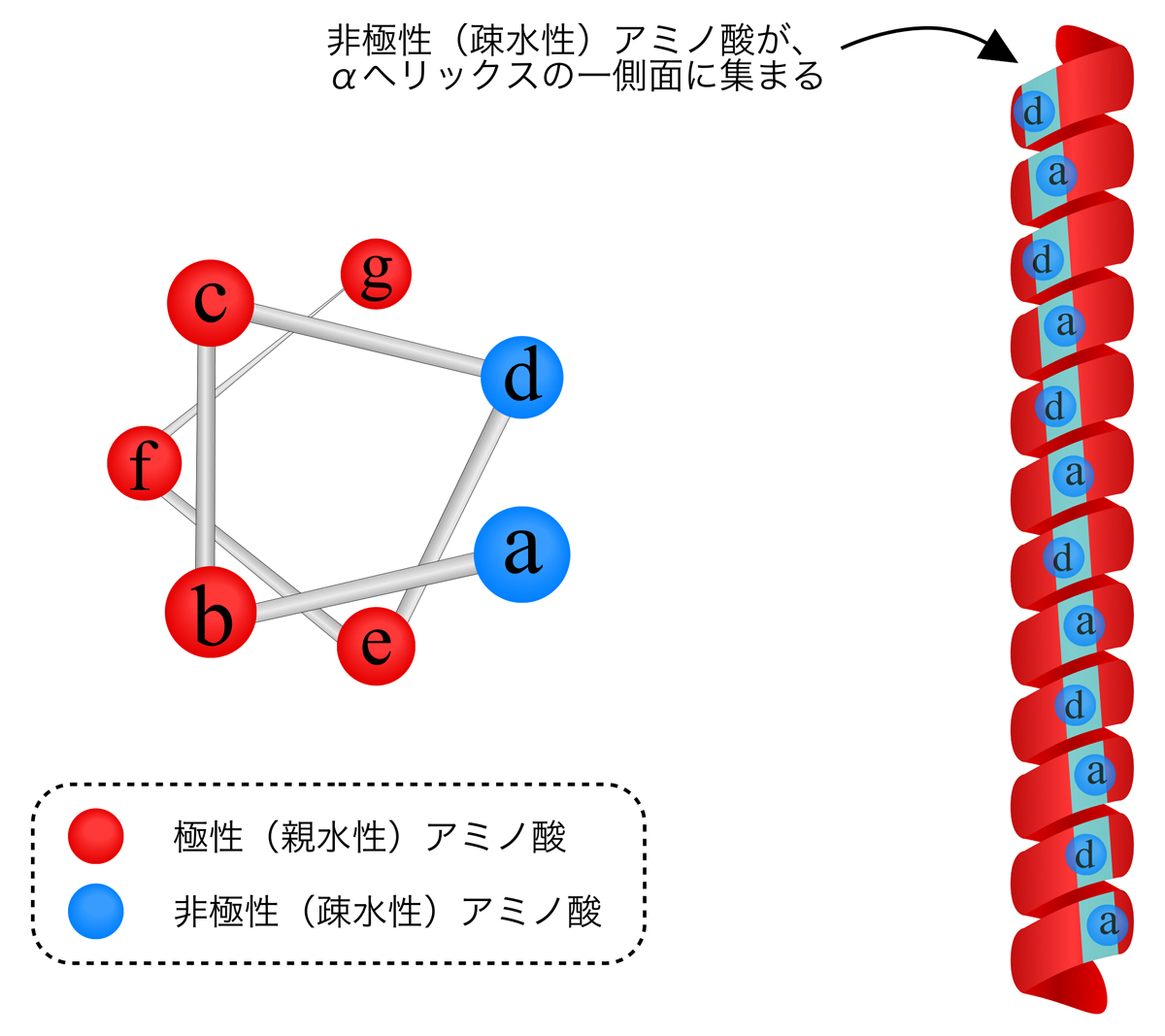
より合わせコイル(coiled-coil)は、2つのαヘリックスの一表面に疎水性側鎖が集まり、互いに内向きになって巻きつき合ったものである。αヘリックスは、らせん1回転あたり3.6アミノ酸という周期性をもつ。つまり約3.5アミノ酸でらせん1回転なので、7アミノ酸でらせん2回転となる。そこで下の図のように、a-b-c-d-e-f-gの7アミノ酸の周期性の中で、aとdの位置に非極性(疎水性)アミノ酸をもつと、ちょうど一表面に疎水性側鎖が集まることになる。
しかし、αヘリックスは3.6アミノ酸で1回転であるのに対し、疎水性アミノ酸は3.5アミノ酸に1個となるので、その差によって疎水性アミノ酸の位置はだんだん左巻きにずれていく。このような2つのαヘリックスが疎水性の側面を内側に隠すように巻き付き合うため、下図のようにコイル状に巻きついて相互作用するのである。
ロイシンジッパー
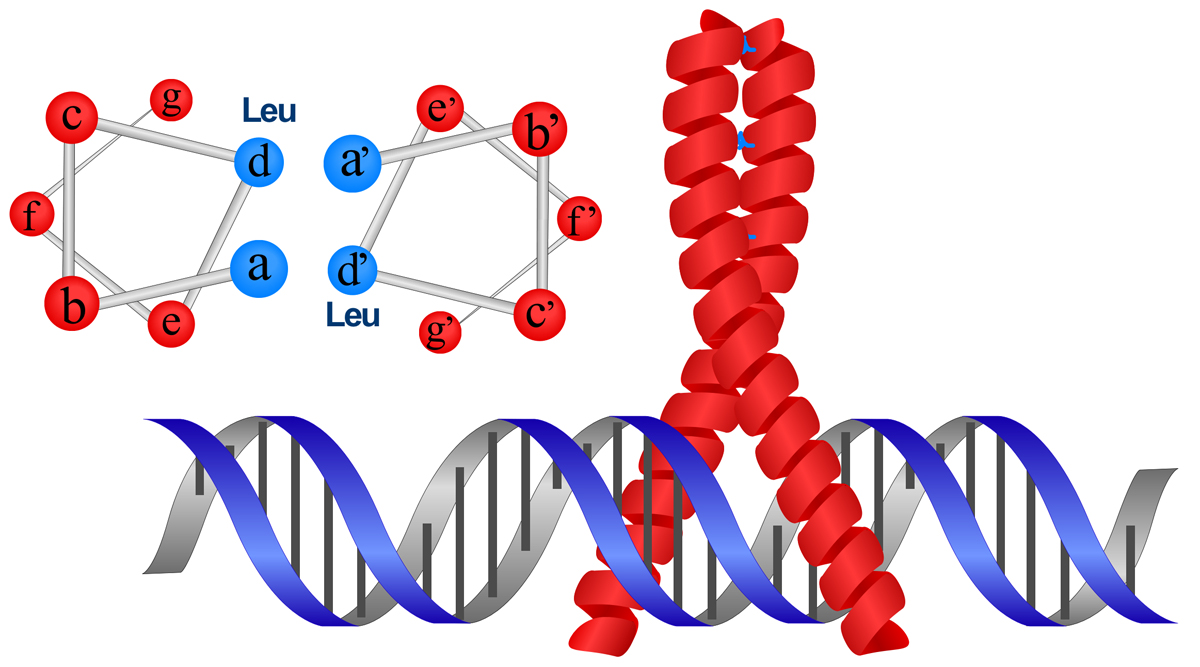
ロイシンジッパー(leucine zipper)は、αヘリックスの一表面にロイシンが集まり、これが第二のαヘリックスのロイシンと接触したものである。上記のa-b-c-d-e-f-gの7アミノ酸で考えると、dの位置にロイシンが現れ、aの位置には他の疎水性アミノ酸がくる。これがより合わせコイルを形成することで、相互作用する。ジッパーと名が付くから、ロイシンが互い違いに噛み合うように想像するかもしれないが、どうやらロイシンどうしが向き合うように相互作用するらしい。
さらに、ロイシンジッパーの接触面の先で2本のαヘリックスが離れることにより逆Y字型になり、これがDNAを挟み込むように結合する。ちょうどDNAの両側面の主溝にはまって、挟む感じである。
ヘリックス-ループ-ヘリックス
ヘリックス-ループ-ヘリックス(helix-loop-helix, HLH)は、ループによってつながれた2つのαヘリックスにより構成される。各αヘリックス一側面には、疎水性アミノ酸がよく保存されており、ループによって2つのαヘリックスが一部重なるような構造になっている。
このようなポリペプチドが2つ集まると、N末側のαヘリックス2つとC末側のαヘリックス2つが平行左巻きの4ヘリックスバンドルを形成する。つまり、4つのαヘリックスが疎水性アミノ酸を内側に隠すように、左巻きにねじれながら相互作用するのである。
またロイシンジッパーの場合と同様に、N末端側のαヘリックスが離れ、これがDNAを挟み込むようにDNAの主溝に接触するらしい。