遺伝子を扱う研究を行うと、必ずプラスミドDNAを扱う実験をすることでしょう。プラスミドを大腸菌に導入し、形質転換を行います。高校や大学の実習でも行うことがあるのではないでしょうか。そこで、そんな実験技術などについても説明していこうと思います。まずは、プラスミドと形質転換から。
プラスミド
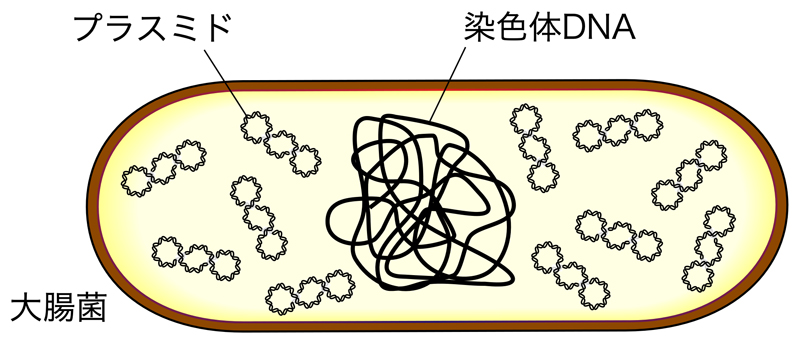
プラスミドとは、細菌などが染色体DNAとは別にもっている小型の環状のDNAで、細胞内で自律的に複製されて世代を通じて安定に維持伝達される。細胞の生存に不可欠なものではないが、抗生物質への耐性などを付与することができる。
バイオテクノロジーではベクター(プラスミドベクター:遺伝子の運び屋)として使われる。遺伝子のクローニングでは、ベクターと遺伝子断片(またはcDNA)をそれぞれ制限酵素で処理する。処理されたこれらの断片を、DNAリガーゼを用いて連結してキメラDNA分子を作製し、これを大腸菌に導入すれば、目的の遺伝子断片(またはcDNA)をもつプラスミドを大腸菌内に保持・増幅させることができる。近年では、DNAリガーゼを使わずにクローニングする様々な方法が開発されているが、それについてはまた別に説明しよう。
一般に、プラスミドベクターは以下の要素をもつ。
- 選択マーカーとしての抗生物質耐性遺伝子
本来大腸菌は抗生物質存在下では生育できないが、プラスミドを導入された大腸菌には、抗生物質耐性が付与される。これを利用すれば、プラスミドを導入された大腸菌と導入されなかった大腸菌を選別できるのである。 - クローニングのためのマルチクローニングサイト
マルチクローニングサイトとは、複数の制限酵素による認識部位が集中的に存在している部分であり、目的の遺伝子断片の挿入を容易にしてくれる。 - 細胞内で認識される複製開始点
プラスミドは、細胞内で複製されるための複製機転をもっている。プラスミドにはColE1やp15Aなどの異なるタイプの複製起点があり、複製起点の種類によって大腸菌内でのプラスミドのコピー数が決まる。また、同じタイプの複製起点をもつ(同じしくみで複製される)プラスミドは同じ細胞内で共存できない「不和合性」という現象が知られている。
形質転換
形質転換といえば、1928年にグリフィス(F. Griffith)が肺炎双球菌で最初に観察した現象である。その後、1944年にアベリー(O.T. Avery)によって形質転換物質の正体がDNAであることが示され、遺伝子がDNAであることが証明されていった。要は、形質転換とは、外部からDNA(遺伝子)を導入されることにより、個体あるいは細胞の性質が変化することである。バイオテクノロジーでは、上述のように大腸菌(細胞)がプラスミドを導入されることであり、これにより本来もっていなかった抗生物質耐性を獲得することになる。
大腸菌の形質転換を行う際、大腸菌が外来DNAを取り込みやすい状態(コンピテントな状態)にする必要がある。このような状態の細胞(大腸菌)をコンピテント細胞とよぶ。1970年、比嘉とマンデルにより、大腸菌を冷やした塩化カルシウム溶液に懸濁してコンピテントな状態にし、そこに42℃で短時間熱ショックを与えると、外来DNAが取り込まれることが示された(1)。また、大腸菌の増殖を対数増殖期の初期〜中期で停止させると、よりコンピテントになることも示された。これが塩化カルシウム法の基礎となった。
その後1983年に、ハナハン(D. Hanahan)によりコンピテント細胞の作製法が改良され、カルシウム(Ca2+)以外にもマンガン(Mn2+)・ルビジウム(Rb+)・ヘキサアンミンコバルト(HACo3+)・DMSO・DTTなどが形質転換の効率を改善することが示された(2)。これにより、ハナハン法が確立された。
さらに、私が現在使っているのは、ハナハン法の条件をさらに最適化して開発された方法(井上法)を使用している。これは、大腸菌の培養を18°Cで行い、カルシウム・マンガン・カリウムという比較的単純な組成の緩衝液に懸濁してコンピテント細胞を作製することで、安定的に高い形質転換効率が得られている(3)。
形質転換法には、上述の化学的形質転換法以外にも、電気穿孔法(エレクトロポレーション)もあるが、ここでは省略する。
大腸菌の遺伝子型
形質転換には、野生型の大腸菌ではなく、目的の応じてさまざまな遺伝的変異をもつ大腸菌株が用いられる。それぞれの変異には、プラスミドを取り扱う上での重要な意味がある。ここでは、私がよく使っているXL10-Gold株を例に説明しよう。XL10-Gold株は、次のような遺伝子型をもつ。
Tetr ∆(mcrA)183 ∆(mcrCB-hsdSMR-mrr)173 endA1 supE44 thi-1 recA1 gyrA96 relA1 lac Hte [ F’ proAB lacIqZ∆M15 Tn10 (Tetr) Amy Camr ]
| TetrとCamr | それぞれ抗生物質テトラサイクリンクロラムフェニコールへの耐性を付与する遺伝子で、菌株を選別するための耐性マーカーとして用いられる |
| endA | Endonuclease I 活性を欠損させ、プラスミドを大腸菌から抽出する際に分解されるのを防ぐ |
| recA1 | 相同組換え能を欠損させ、導入したプラスミドが大腸菌(宿主)のDNAと組換えを起こすのを防ぐ |
| lac | lacオペロンの欠損 |
| lacIq | Lacリプレッサーを過剰生産するようなプロモーターの変異 |
| lacZ∆M15 | β-ガラクトシダーゼC末端のω-ペプチドをコードしている |
| ∆(mcrA)183 ∆(mcrCB-hsdSMR-mrr) |
導入されたプラスミドを外敵とみなして分解されないよう、制限修飾系の遺伝子(以下参照)を欠損させている |
| hsdR:エンドヌクレアーゼ(制限酵素 EcoKI) hsdMとhsdS:複合体を形成して機能するメチル化酵素(hsdSがDNA配列を認識し、hsdMがメチル化) ゲノムDNAはメチル化修飾をもつことも多いため、メチル化DNAのクローニングにも使えるような遺伝子にも変異をもつ |
大腸菌の形質転換の手順と原理
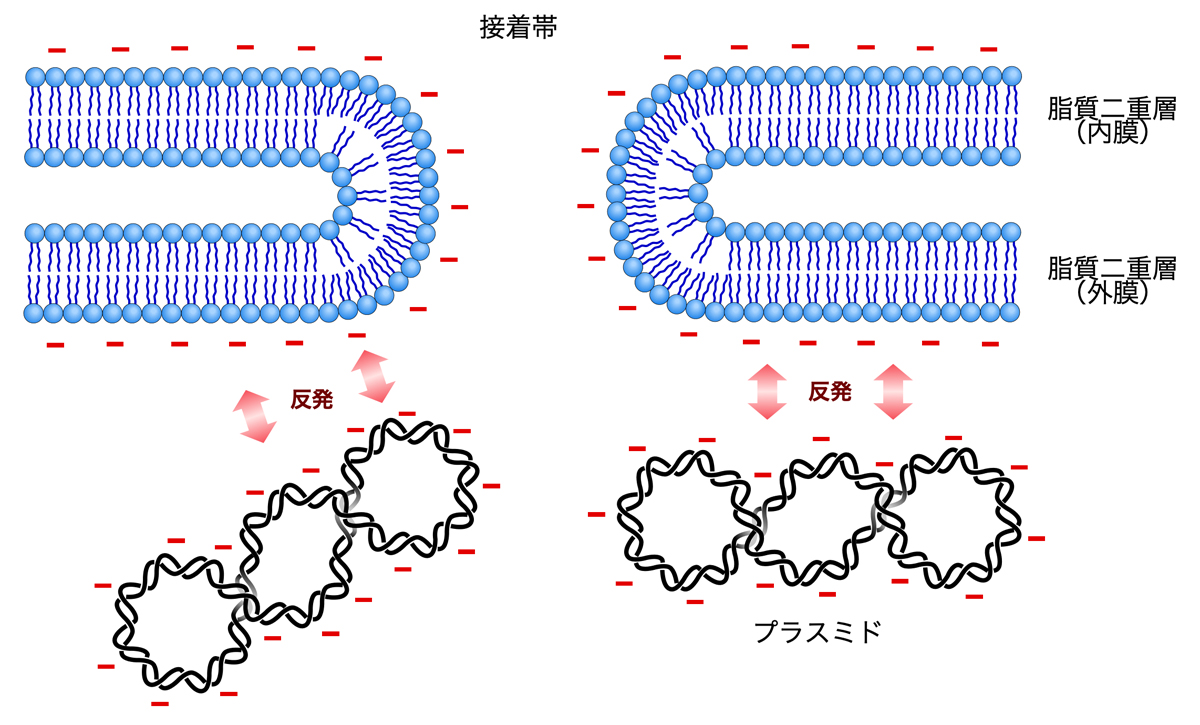
大腸菌とプラスミドを混ぜて熱ショックをかけるという簡単な方法により、なぜプラスミドが大腸菌内に入るのか。それは、大腸菌の内膜と外膜が融合して穴をあけている接着帯(adhesion zone)をプラスミドが通過するからのようである。対数増殖期の大腸菌には数百個の接着帯があるようで、対数増殖期の初期〜中期でよりコンピテントになる事実と合致する。
しかし、大腸菌とプラスミドをただ混ぜただけでは、プラスミドは接着帯を通過できない。それは、大腸菌の細胞膜を構成するリン脂質がマイナスの電荷をもっており、DNA中のリン酸基もマイナスの電荷をもっているからである。つまり、両者はマイナスの電荷どうしで静電的に反発することになる。
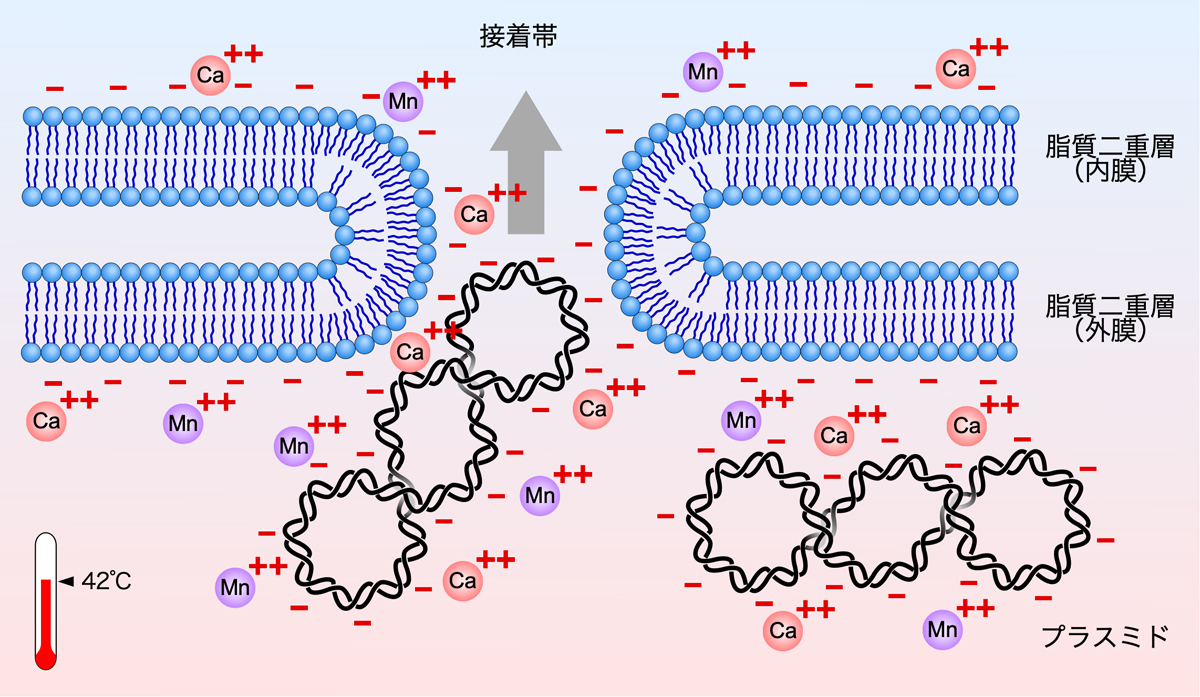
そこで、形質転換に用いるコンピテント細胞を作製する際には、対数増殖期の大腸菌を塩化カルシウムや塩化マンガン、塩化カリウムを含む緩衝液に懸濁する。そこにプラスミドを加えて氷冷しておくと、カルシウム(Ca2+)やマンガン(Mn2+)によりプラスミドとリン脂質のマイナス電荷が打ち消され、両者の反発がなくなる。
そこで、42℃で短時間熱ショックを与えると、大腸菌の細胞の内外で一時的に温度差が生じ、これがポンプの役割を果たして流れが生じる。これにより、大腸菌の細胞外(表面)にあったプラスミドが接着帯を通して細胞内に入るのである。
あとは、回復培養ののちに、抗生物質を含む寒天培地に大腸菌を播種すれば、プラスミドを導入されて抗生物質耐性を獲得した大腸菌のみが生育してコロニーを形成することになる。ちなみに、コロニーというのは、寒天培地に播種した1匹の大腸菌が目視できるくらいまで増殖したものである。したがって、コロニーの数を計測すれば、この実験で何匹の大腸菌がプラスミドを受け取って抗生物質耐性を獲得したかがわかる。
カラーセレクション
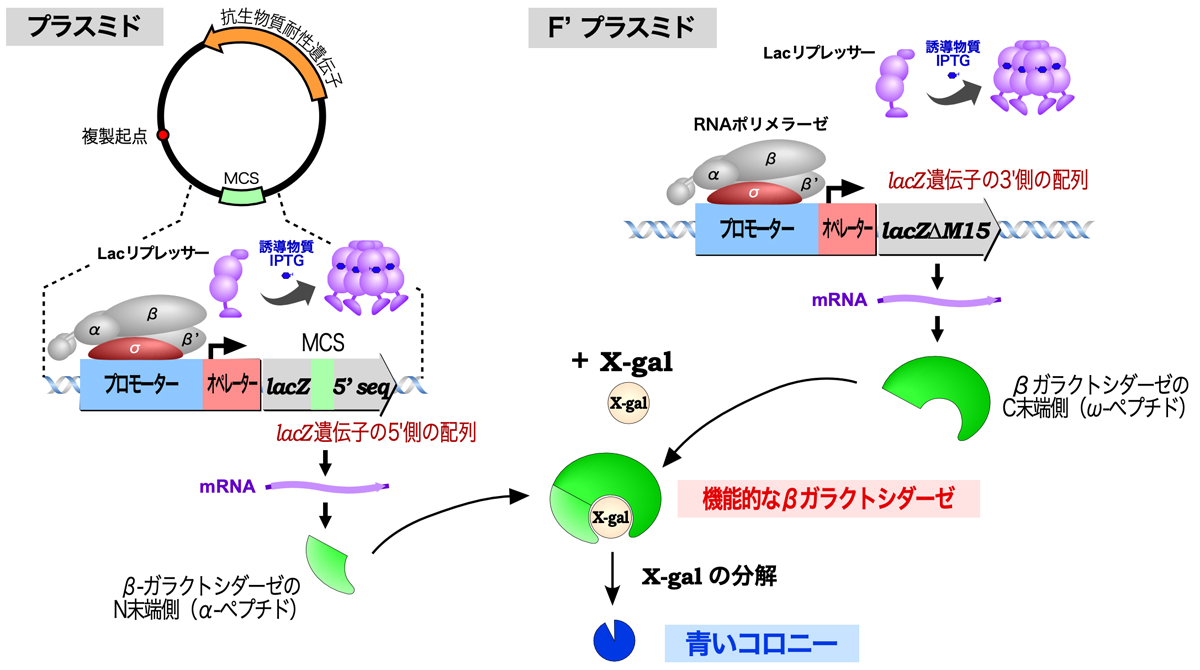
上述のような方法で大腸菌にプラスミドを導入することができる。しかし遺伝子のクローニングの際には、導入されたプラスミドに外来DNAが挿入されているかどうかが重要である。そこで使われるのが、カラーセレクション(ブルー・ホワイトセレクション:青白選択)である。カラーセレクションを行うには、大腸菌とプラスミドの両方に重要な仕掛けがある。この仕掛けには、lacオペロンの発現システムが利用されているので、まずはlacオペロンのおさらいをしておこう。
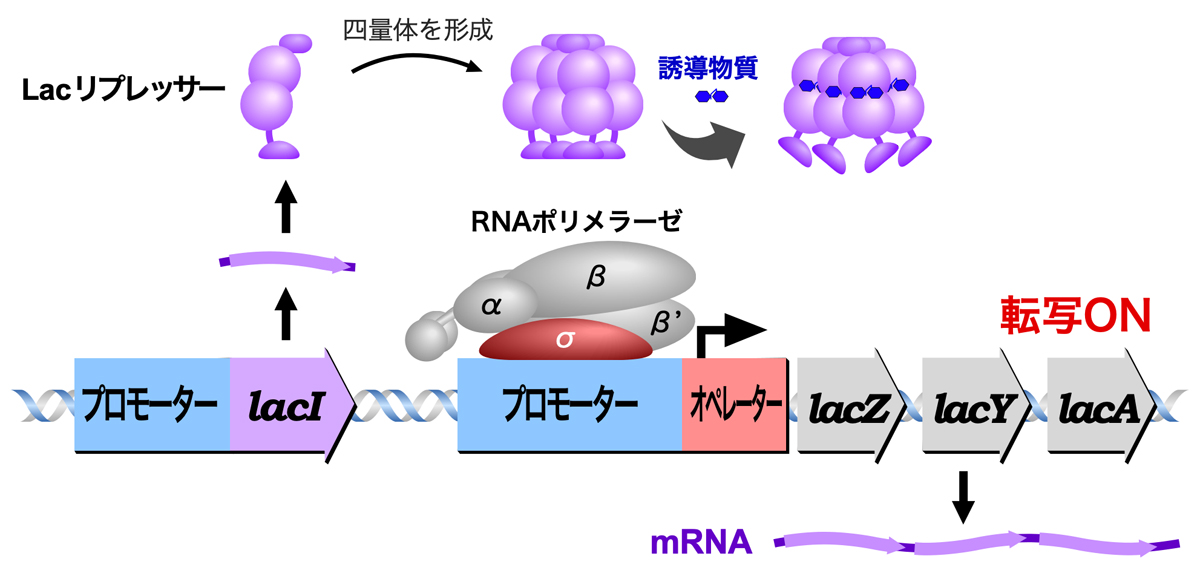
lacオペロンでは、lacI遺伝子からLacリプレッサーが発現し、これが四量体を形成してオペレーターに結合することで、3つの構造遺伝子(lacZ, lacY, lacA)の発現が抑制されている。しかし、生育環境中にラクトースが存在すると、誘導物質(1,6-アロラクトース)が作られてLacリプレッサーに結合し、Lacリプレッサーはオペレーターに結合できなくなる。こうしてLacリプレッサーによる抑制が解除され、3つの構造遺伝子が発現する。
カラーセレクションに使われる仕掛けのひとつは、大腸菌がlacZΔM15という遺伝子変異をもっていること。上述のXL10-Gold株の場合、染色体DNA中のlacオペロンを欠損している代わりに、F’プラスミド中にlacZΔM15遺伝子変異をもっている。lacZΔM15はlacZ遺伝子の3’側の配列をもち、5’側の配列を欠損している。したがって、lacZΔM15からはβガラクトシダーゼC末端側のω-ペプチド(N末端側を欠損)が発現する。また、導入するプラスミドにはlacZ遺伝子の5’側の配列中にあり、βガラクトシダーゼN末端側のα-ペプチドが発現する。
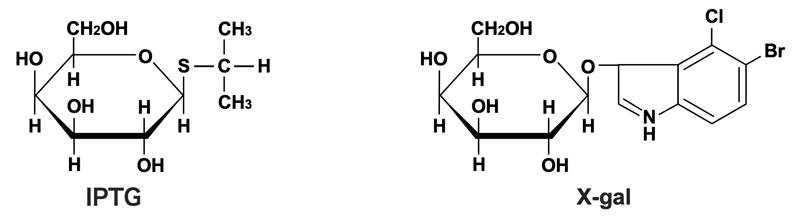
そして両者の発現には、lacオペロンの調節システムが使われる。ω-ペプチドとα-ペプチドの発現は、lacI q変異により過剰生産されたLacリプレッサーにより抑制されている。しかし、人工的な誘導物質であるIPTG(イソプロピル-β-チオガラクトピラノシド)を加えると、抑制が解除されてω-ペプチドとα-ペプチドが発現する。ω-ペプチドとα-ペプチドはそれぞれ単独では機能的な酵素としてはたらけないが、両者が揃うと機能的な酵素となる(これをα相補性という)。そこで基質となるX-gal(5-ブロモ-4-クロロ-3-インドリル-β-D-ガラクトピラノシド)を加えておくと、機能的な酵素によりX-galが分解されて青色の色素が形成されるため、コロニーは青くなる。
しかし、導入するプラスミドのMCSは、lacZ遺伝子の5’側の配列(α-ペプチドのコード領域)中にある。そのため、MCSに外来DNAが挿入されるとα-ペプチドのコード領域が分断され、ω-ペプチドの機能を相補できるような無傷のα-ペプチドが合成されない。したがって、IPTGとX-galを加えても機能的なβガラクトシダーゼはできず、X-galが分解されないからコロニーは白くなるのである。
参考文献
1) Mandel, M. and Higa, A. (1970) J. Mol. Biol. 53, 159-162
2) Hanahan, D. (1983) J. Mol. Biol. 166, 557-580
3) Inoue, H., Hojima, H. and Okayama, H. (1990) Gene 96, 23-28