このHPは遺伝子について語るところではあるが、タンパク質は遺伝子がコードする産物であるとともに、遺伝子を調節する上で欠かせない役者となっている。そこで、タンパク質(ポリペプチド)についても、その基本的構造を少し紹介しよう。
アミノ酸
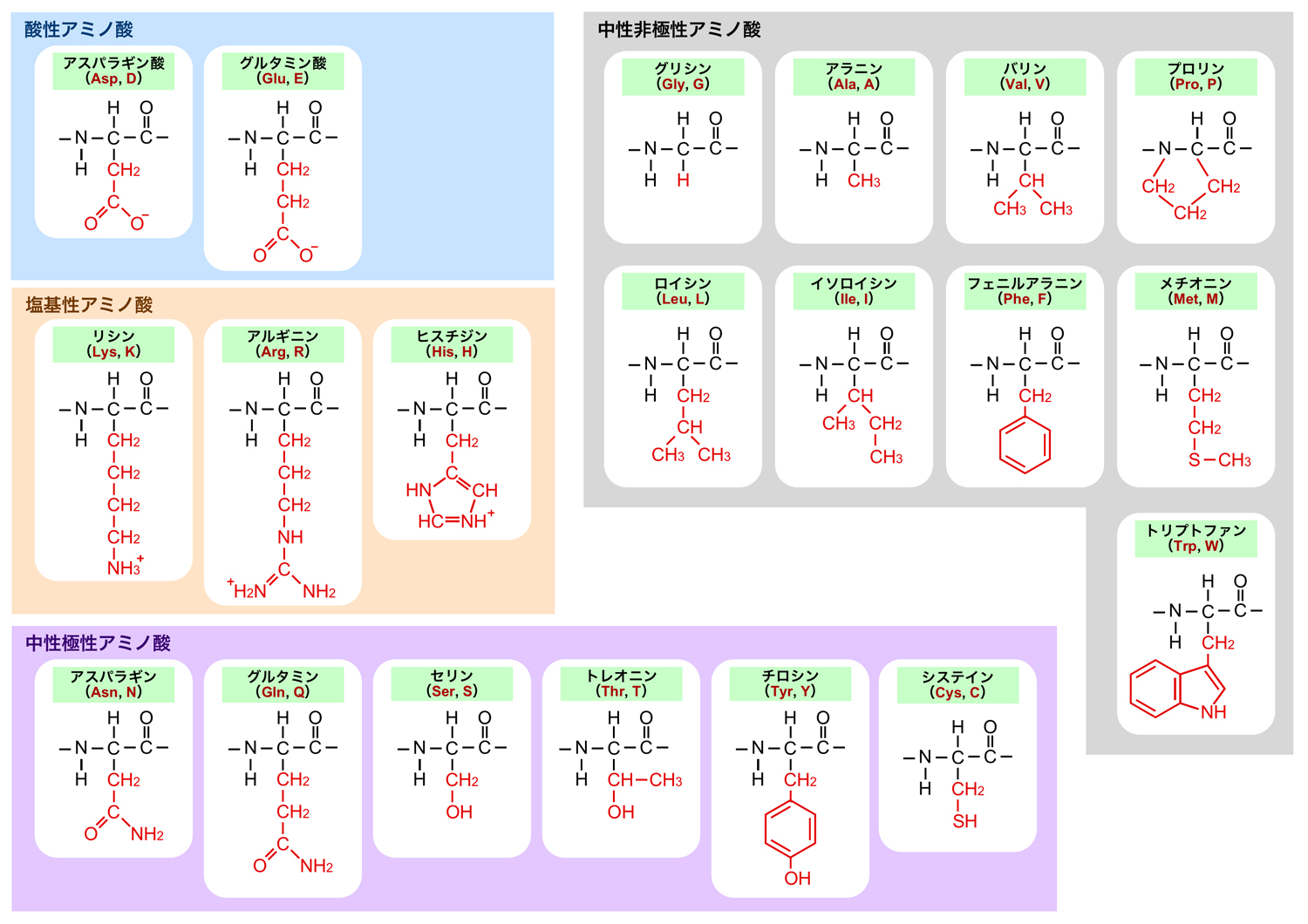
DNA上の遺伝情報はA•G•C•Tの4塩基で記載されたデジタル情報であり、これが翻訳されてタンパク質となることで、そのデジタル情報が具体的な酵素活性などの活動として発現することになる。タンパク質の構成単位はアミノ酸であり、生物がもつタンパク質には20種類のアミノ酸が使われている。
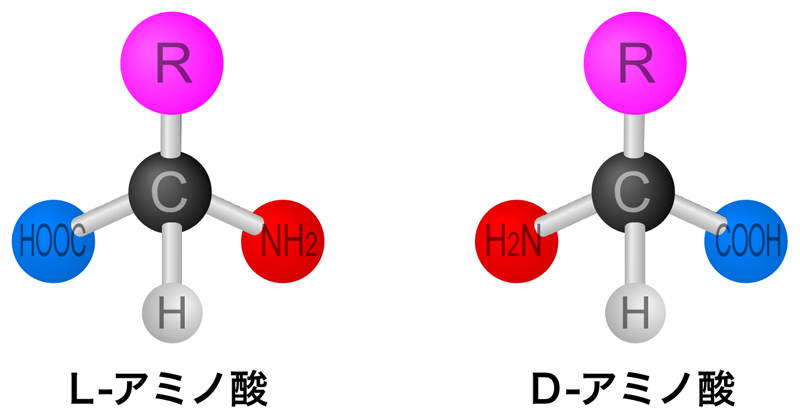
アミノ酸の中心のα-炭素にある4つの置換基のうち、3個がアミノ基(NH2基)・カルボキシル基(COOH基)・水素となっている。残りの置換基(R)は側鎖とよばれ、この側鎖の性質によりアミノ酸の特徴が決まる。したがって、タンパク質の性質・特徴も、どのような側鎖のアミノ酸がどのように配置されかで決まる。
アミノ酸は、α-炭素を中心とした四面体構造の頂点に4つの置換基が配置されるような構造となっている。そのため、側鎖(R)がHであるグリシン以外のアミノ酸には、下図のように鏡像異性体が存在する。すなわち、右手と左手のように、重ね合せることができない。
おもしろいことに、タンパク質を構成しているアミノ酸はすべてL-アミノ酸である。
ポリペプチド
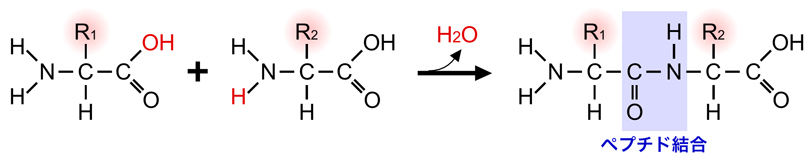
タンパク質は、20種類のアミノ酸は遺伝情報にしたがって直鎖上に連結したものである。アミノ酸を連結する際は、1つのアミノ酸のアミノ基(-NH2)と別のアミノ酸のカルボキシル基(-COOH)から1分子の水が取れて脱水縮合を起こし、これによって新しい結合が形成される。こうして形成された-CO-NH-の部分が、ペプチド結合である。
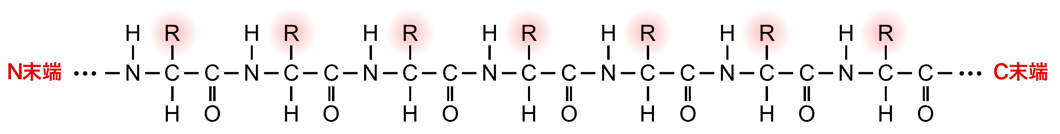
こうして2個以上のアミノ酸が連結したものをペプチドといい、長く連結したものをポリペプチドという。直鎖上のポリペプチドにおいて、アミノ酸との連結に使われなかったアミノ基(-NH2)残っている側の末端をN末端、カルボキシル基(-COOH)が残っている側の末端をC末端という。
結局、アミノ酸のα-炭素がペプチド結合を介して連結したものがポリペプチドの主鎖を構成し、そこからアミノ酸の側鎖がとびだした形となっている。
極性アミノ酸と非極性アミノ酸
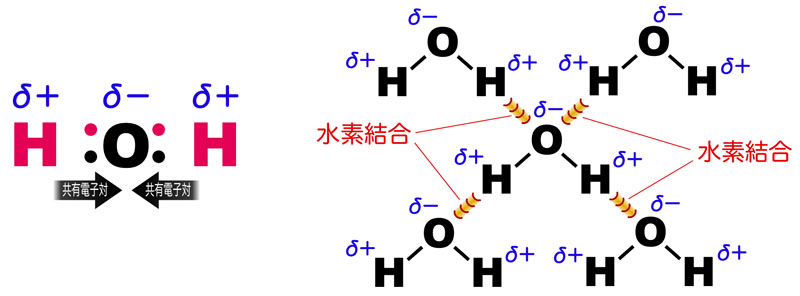
20種類のアミノ酸を水への溶解度によって大きく分類すると、親水性アミノ酸と疎水性アミノ酸に分けられる。水分子は電気的な偏りをもつため、同じく電気的な偏り(極性)をもつアミノ酸や電荷をもつアミノ酸は親水性となる。一方、このような電気的な偏りをもたないアミノ酸は疎水性となる。
さらに細かく分類してみよう。
親水性アミノ酸のうち、中性の条件下でマイナス(―)の電荷をもつものを酸性アミノ酸、中性の条件下でプラス(+)の電荷をもつものを塩基性アミノ酸、電荷はもたないが極性をもつものを中性極性アミノ酸という。疎水性アミノ酸は、すべて中性非極性アミノ酸となる。
タンパク質が適切に機能するためには、ただアミノ酸が直鎖上に並ぶだけではダメで、適切に折りたたまれて特定の立体構造を形成する必要がある。水溶液中では、疎水性アミノ酸を内側に隠して水に触れないようにし、親水性アミノ酸を外側に向けるようにしている。このような立体構造を形成する上でも、親水性か疎水性かは重要である。
αヘリックス
上述のように、タンパク質が適切に機能するためには、適切に折りたたまれなくてはならない。タンパク質全体の三次元構造も重要だが、部分的に形成される規則的な立体構造(二次構造)も各所の機能にとって重要となる。そこで、2つの二次構造を紹介しよう。まずは、αヘリックスである。
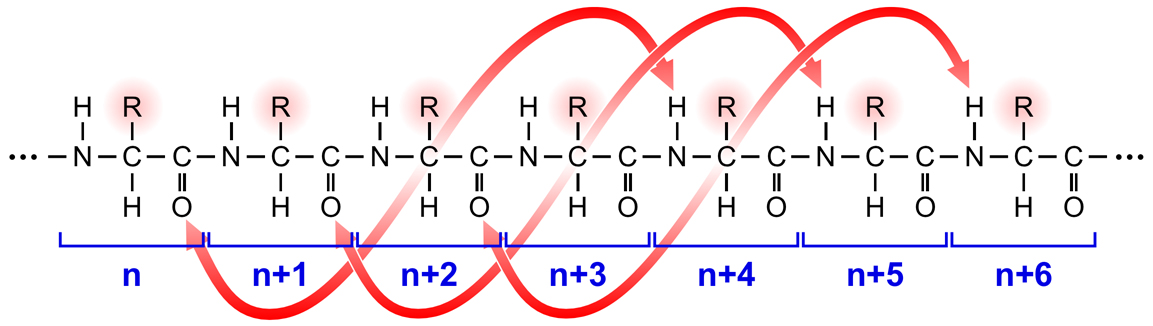
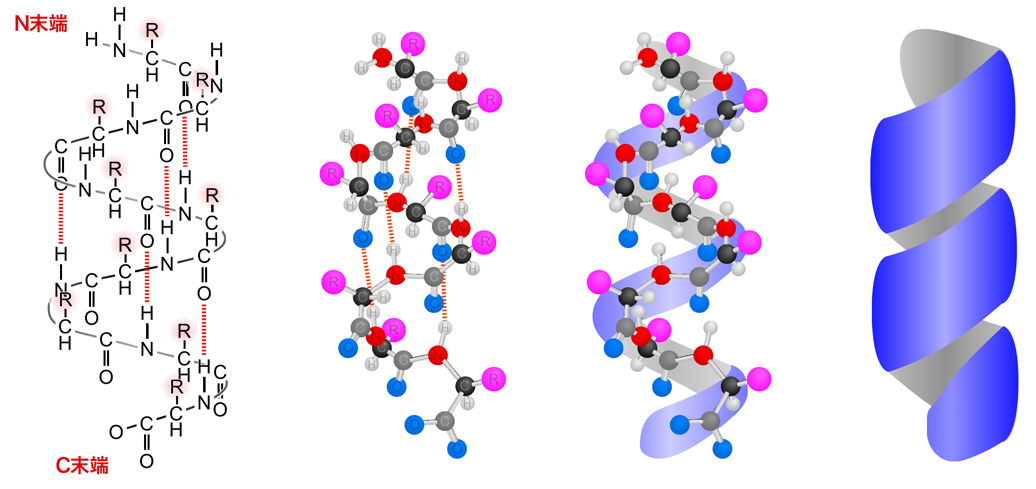
αヘリックスは、主鎖を構成する原子間の水素結合によって形成される右巻きらせん構造である。具体的には、n番目のアミノ酸のC=Oとn+4番目のアミノ酸のN-Hとの間で水素結合が形成されることにより、3.6アミノ酸で1回転する右巻きのらせん構造となる。
下の図で、赤の点線で示されているのが水素結合である。このようなαヘリックス構造では、らせんを形成しているのは主鎖であり、アミノ酸の側鎖はらせん構造から突き出すかたちとなっている。したがって、この自由に使える側鎖がその特性を十分に発揮できる構造となっている。
αヘリックスの形成に側鎖は関与しないが、影響はするようである。アラニン・ロイシン・メチオニン・グルタミン・グルタミン酸・リジン・アルギニン・ヒスチジンのように、αヘリックスを形成しやすいアミノ酸もあるが、形成を阻害するアミノ酸もある。プロリンは側鎖が主鎖と環状構造を形成しており、この環状構造がらせんの回転を妨げるため、プロリンがある部分にはαヘリックスは形成されない。
βシート
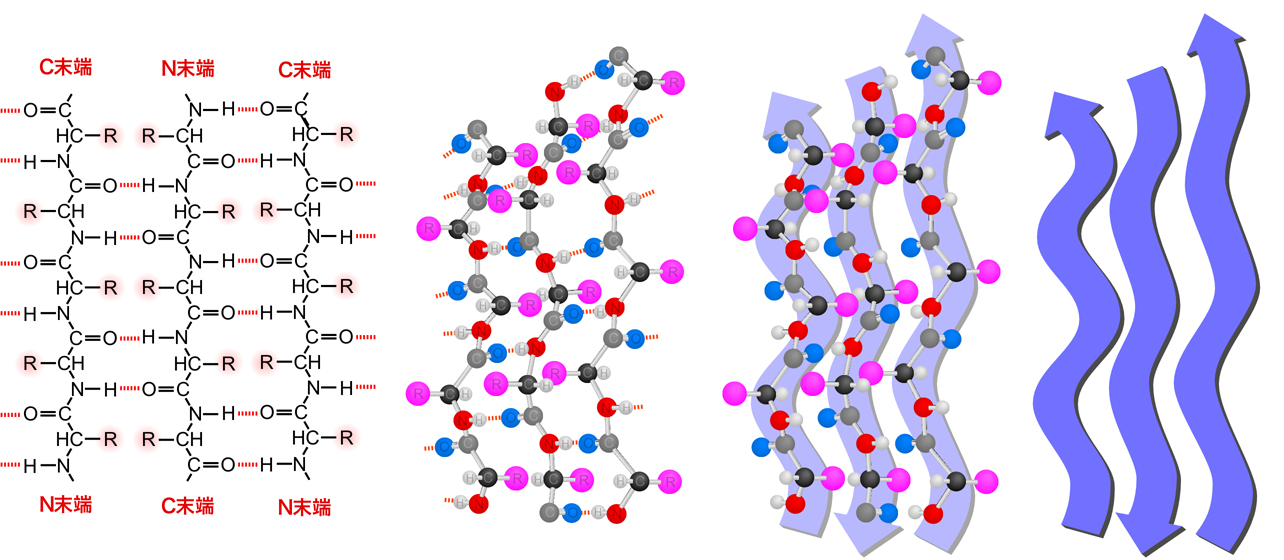
βシートは、ポリペプチド鎖の異なる領域が隣り合って並び、水素結合を介して結合したシート構造である。βシートも、主鎖を構成しているN-HとC=Oの間で水素結合が形成されているため、側鎖はシート構造から突き出たかたちとなる。したがってαヘリックスと同様、側鎖がその特性を十分に発揮できる構造となっている。
βシートにも、バリン・イソロイシン・フェニルアラニン・トリプトファン・スレオニン・チロシンなど、βシートを形成しやすいアミノ酸があるようである。またβシートには、水素結合する2本のポリペプチドが逆向きとなる逆並行βシートと、2本のポリペプチドの向きが同一となる並行βシートの2種類がある。上の図のβシートは、逆並行βシートである。