ファージディスプレイの抗体への応用が評価されて、Gregory P. Winter博士が2018年のノーベル化学賞を受賞しました。この貢献は、後の抗体医薬品の開発につながるものです。そこでこの頁では、ファージディスプレイと抗体医薬品の開発について解説しましょう。
モノクローナル抗体
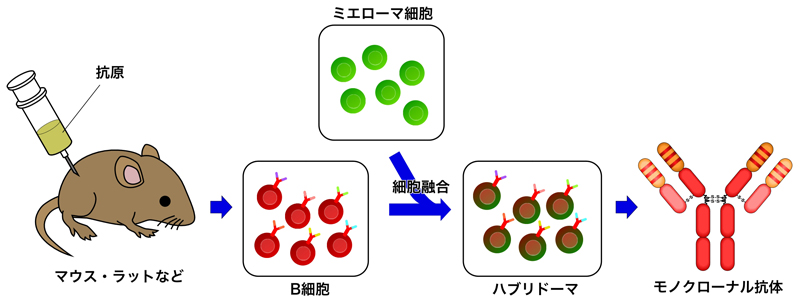
モノクローナル抗体とは、単一の抗体産生細胞に由来するクローンから得られた抗体のことである。マウスに抗原を投与し、脾臓から抗体を産生するB細胞を分離した後に、不死化させるためにミエローマ細胞(免疫グロブリンを大量に生産するマウス骨髄腫由来の細胞)と細胞融合を行うことで、モノクロナール抗体を作製する。単一の抗体産生細胞に由来するため、抗原特異性が全く同じである単一の抗体分子種が得られる。モノクローナル抗体を作製する方法を1975年に発明したGeorges J. F. KöhlerとCésar Milsteinは1984年にノーベル生理学・医学賞を受賞した。
モノクローナル抗体は、標的をピンポイントで狙い撃ちできる医薬品として期待された。しかし、マウスに由来するモノクローナル抗体は、ヒトに投与すると投与した抗体に対する抗体が産生されるため、臨床に応用することは困難であった。
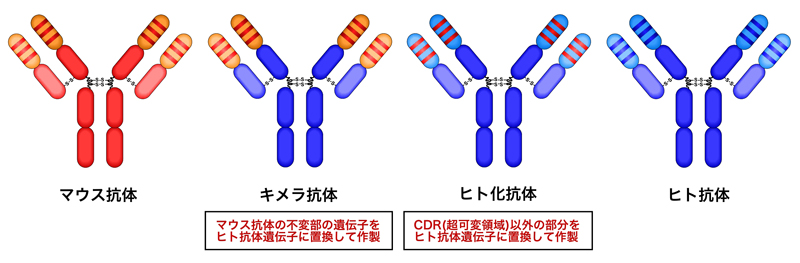
そこで副作用の軽減のために、遺伝子工学の技術により、マウスのモノクローナル抗体の『ヒト化』が行われた。つまり、マウスモノクローナル抗体中の定常領域をヒトの定常領域に置換したキメラ抗体、マウスの超可変領域(CDR)以外の部分をヒト抗体遺伝子に置換したヒト型化抗体が作製された。現在でも、キメラ抗体やヒト型化抗体が臨床応用されている。
抗体のフォーマット
特定の抗原に対する抗体を単離するために、抗体分子をファージに提示させるファージディスプレイが行われた。しかし、完全な抗体分子(IgG)は、2つ以上の鎖で構成される巨大な分子であるため、ファージ上に提示するのは難しい。そこで、特殊な抗体のフォーマットが使われる。
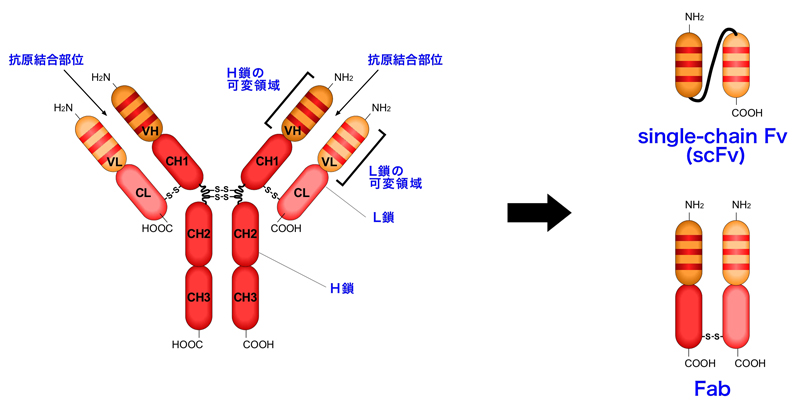
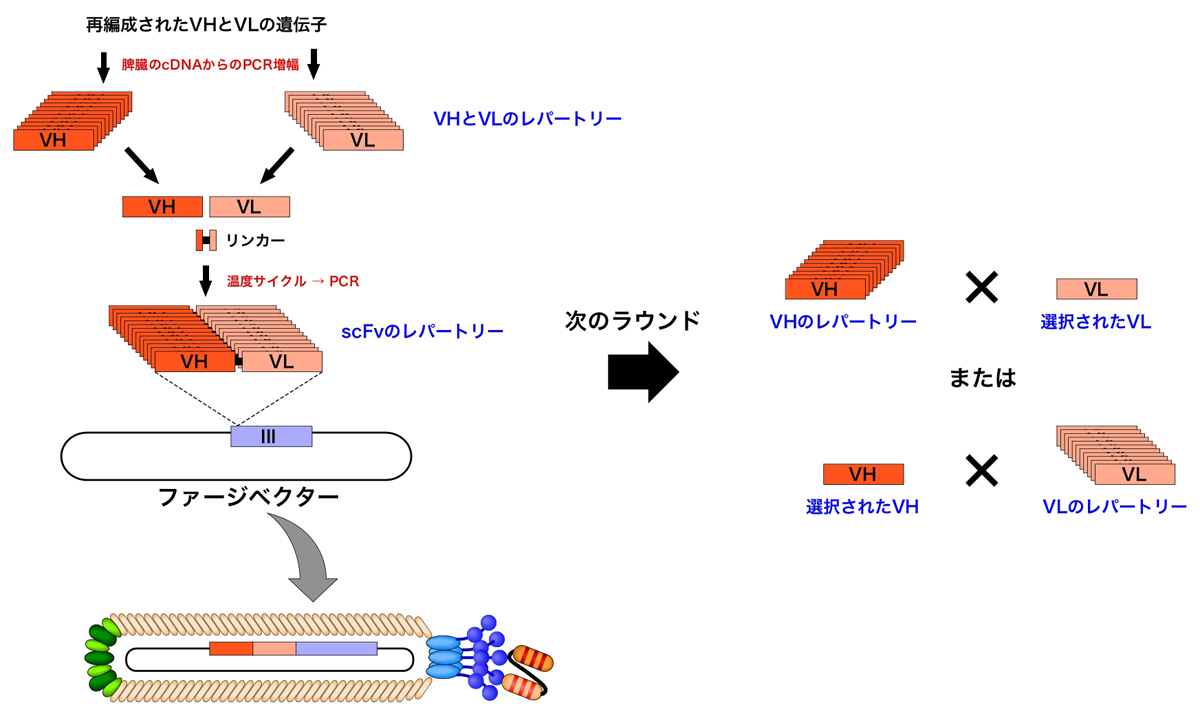
ひとつは、H鎖の可変領域(VH)とL鎖の可変領域(VL)をリンカーでつないだscFv(single chain fragment variable)である。単一のポリペプチドで抗原への親和性をもたせることができ、さらに低分子なため細菌などでも容易に発現させることができる。
もう一つは、Fab(Fragment antigen binding)である。抗体分子(IgG)をパパインで消化すると、2つのFabとFcに分離される。FabはVH-CH1とVL-CLがジスルフィド結合で連結されたものであり、抗原の認識を担う。Fcの方は、Fc受容体をもつナチュラルキラー細胞(NK細胞)やマクロファージなどのエフェクター細胞を活性化して抗体の可変領域が結合した標的細胞を殺す役割を担う(エフェクター機能)。
抗体フラグメントscFvのファージディスプレイ
ファージを使った最初の抗体ライブラリは、1989年に溶菌性のλファージで作られていた。しかし1990年Winter博士は、雌鶏の卵白リゾチームで免疫されたマウスからのscFvを繊維状ファージのpIIIと融合させてファージディスプレイを行った(1)。このscFVを提示する繊維状ファージは、雌鶏の卵白リゾチームには結合したが、ヒト・七面鳥の卵白リゾチームには結合しなかった。つまり、scFVはファージの表面に提示された状態でも機能的であることを示している。さらに、2ラウンドのアフィニティ精製により、このscFvファージを100万倍に濃縮できることも示した。
抗体フラグメントFabのファージディスプレイ
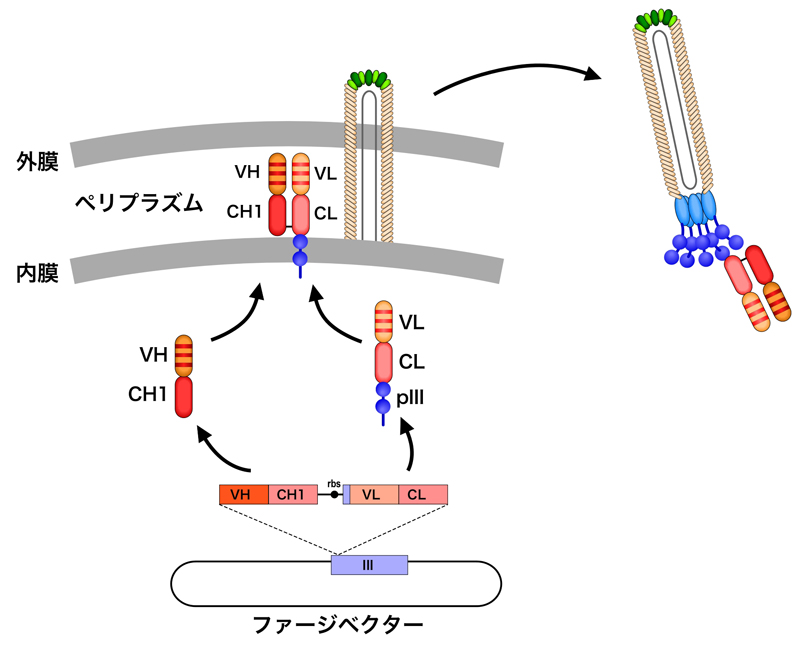
1991年にLerner博士のグループにより、外殻タンパク質pVIIIと融合してファージの表面全体にFabを提示したライブラリーが報告された(2)。この方法では、H鎖のVH-CH1をpVIIIと融合させ、L鎖(VL-CL)は分泌型とした。さらに両者に大腸菌のペリプラズムへ移行するシグナルを付けておくことで、VH-CH1を内膜にアンカーし、ペリプラズム内でVL-CLとジスルフィド結合で連結させ、Fabを構築するのである。そして、繊維状ファージの粒子形成の際にpVIIIと融合したFabが取り込まれ、Fabがファージ表面に提示されるのである。しかも、バイオパニングにより2700倍に濃縮できた。
同じ1991年に、Winter博士のグループは、pIIIと融合したFabのファージディスプレイを報告している(3)。概要は上記のpVIIIを用いた系と同じで、H鎖のVH-CH1をpIIIと融合させ、L鎖(VL-CL)は分泌型とし、両者にペリプラズムへ移行するシグナルを付けた。逆に、H鎖のVH-CH1を分泌型、L鎖(VL-CL)をpIIIと融合させたものも作製したが、どちらでも機能的なFabが得られた。
ファージ抗体ライブラリーの種類
抗体のライブラリーには3つのタイプがあるので、ここで簡単に紹介しよう。
① 免疫ライブラリー
マウスなどの実験動物を特定の抗原で免疫し、抗体応答を十分に高めたあとで、その動物のリンパ球から作製したもの。免疫によって親和性が増強された抗体遺伝子由来なので、親和性の高い抗体クローンを単離することができる。
② ナイーブライブラリー
無菌室で飼育され、特定の抗原による免疫を受けていない実験動物のリンパ球由来の抗体遺伝子をもとに構築された抗体ライブラリー。ヒトの場合は、健常人由来のライブラリーを指す。免疫ライブラリーと違って抗原特異的なクローンが少ないが、得られる抗体としては十分な親和性をもつものが得られる。
③ 合成ライブラリー
相補性決定領域(CDR)などの抗原結合領域の部分に、ランダムなアミノ酸配列をコードする合成オリゴヌクレオチドを挿入してライブラリー化したもの。
抗体ライブラリーのファージディスプレイ
1991年に、繊維状ファージ上に提示された抗体ライブラリーが多数報告された。
Winter博士のグループによるライブラリーは、phOxで免疫されたマウスに由来するscFvのライブラリーで、pIIIタンパク質のN末端に提示された。さらに、レジン上に固定されたphOx抗原を使って、最初のライブラリーからphOx結合抗体を選択することが可能で、選択ラウンドごとに高親和性抗体の割合が増加することを示した(4)。しかも、選択されたVLとVHのレパートリーあるいはその逆で組み合わせて、VHとVL遺伝子を選択ラウンド間でシャッフルすることにより、免疫されたマウスに存在しなかった新しい組み合わせのVH-VLを作り出すし、より親和性の高い抗体を作れることを見出した。
その後すぐ、ファージ表面のpIIIに融合して提示させたFabライブラリーが報告された。このライブラリは、tetanus toxinで免疫されたマウスに由来する少ないFabを含んでおり、バイオパニングにより非結合ファージのバックグランドからtetanus toxinに結合するものを選択するのに使われた。
別の報告では、HIV陽性のヒトの骨髄に由来する、1000万配列をもつFabライブラリーが報告され、ウイルス表面の糖タンパク質gp120に対する高親和性Fab抗体を得るのに使われた。
大腸菌を使って体細胞超変異をまねる
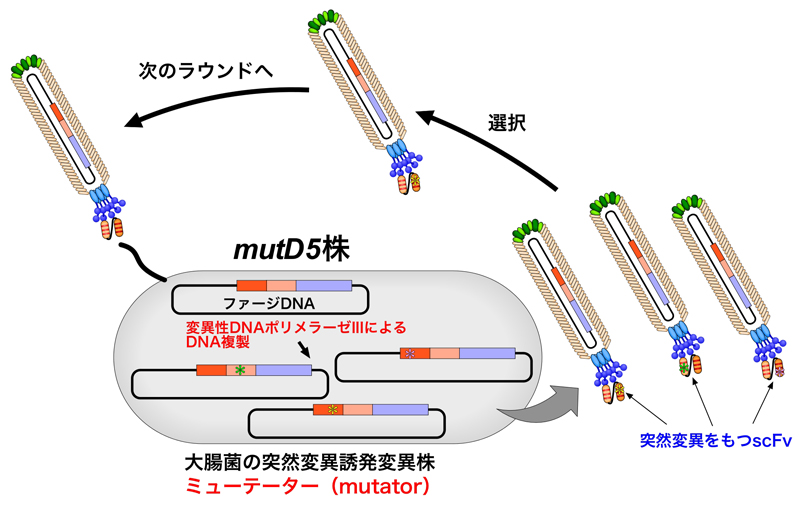
1996年に、体内の抗体産生で起こる体細胞超変異を大腸菌を使ってまねる研究がWinter博士のグループにより報告された(5)。
抗αphOx15抗体のscFvを提示するファージを、大腸菌のミューテータ一株(mutD5株)を使って増幅された。mutD5株は、DNAポリメラーゼIIIのεサブユニットの欠損株であり、3’→5’エキソヌクレアーゼ活性を欠損しているくため、校正機能がない。このmutD5株の最小培地での変異率は野生型の480倍、RICH培地での変異率は野生型の37,000倍といわれる。
このmutD5株を使って、scFvファージを99から4.8×1012に増幅した。4ラウンドの変異・選択サイクルの結果、875 bpに1つの変異を導入することに成功した(1回のラウンドだけだと2100 bpに1つの変異)。
以上のように、機能的抗体断片のファージディスプレイを使うと、目的の抗原に高い親和性で結合する抗体を効果的に得られることが分かった。ここで重要なことは、この技術により、目的の抗体を作製するのに、動物に免疫する必要がなくなったことである。毒性の抗原・宿主を傷つける抗原を動物に注射して、動物を苦しめなくてすむのである。
ヒト由来抗体ライブラリー
1991年、ヒト由来の抗体ライブラリーが報告された(6)。
2名の健常なヒト(免疫されていないヒト)から108個のBリンパ球を含む血液が採取され、IgMのVHとVL(2700万種)またはIgGのVHとVL(1億6000万種)の組み合わせとしてscFvライブラリーが構築された。4ラウンドのバイオパニングでライブラリーから高親和性の抗体を得られることが、phOx, 七面鳥卵白リゾチーム, BSAを抗原として使って証明された。
抗体ライブラリーから得られたscFvを医薬品として用いるには、そのフォーマットが重要となる。scFvは完全抗体に比べて組織への浸透効率がよいというメリットがある一方で、完全抗体には生体内での安定性の増加、エフェクター機能などのメリットがあるため、抗体を生体内で長期間作用させ、抗原を発現している細胞を駆除したい場合にはscFvを完全抗体へ変換した方が有利となる。
scFvを完全抗体へと変換するには、scFVからVHとVLをそれぞれPCRにより増幅し、これをヒト抗体の定常領域をもつ発現ベクターに挿入すればよい。これをCHO細胞などの動物細胞で発現させればよいのである。しかし、こうしてヒト完全抗体を作製しても、発現に用いたCHO細胞に特有の翻訳後修飾(糖鎖の形成)があったりすると、やはり問題を生じる場合がある。
ヒト抗TNFα抗体の作製
抗体のファージディスプレイを利用して作製されたヒト抗体が医薬品として使われた例をひとつ紹介しよう。それは、関節リウマチの原因となるTNFαに対する完全ヒト抗体の作製である。ここで使われたのは、マウスの抗ヒトTNF-α抗体をもとに、ファージディスプレイ技術を利用したGuiding the selectionと呼ばれる手法である(7)。
はじめに、マウスの抗ヒトTNFα抗体(MAb32)のVH-CH1(H鎖)とヒト末梢血由来のVL-CL(L鎖)を提示する抗体ファージライブラリー(Fab)を用いて、TNFαに結合するヒト由来の抗体(L鎖)が選択された。次に、単離されたヒト由来のVL-CL(L鎖)とヒト末梢血由来のVH-CH1(H鎖)を提示するFabライブラリーを用いて、TNFαに結合する抗体VH-CH1(H鎖)が単離された。結果として、H鎖・L鎖の両方がヒトに由来する抗体が構築され、完全ヒト型のモノクロナール抗体の取得に成功したのである。
これが、ファージディスプレイによる完全ヒト抗体医薬品として、2002年にアメリカで最初に認可されたアダリムマブ(ヒュミラ)である。アダリムマブ(ヒュミラ)は、日本では2008年3月に関節リウマチに対し承認された。このファージディスプレイ技術を使って、様々なヒト抗体が作製され、炎症性疾患やがんに対して臨床的に使われている。